Am 13. Dezember wurden der 40. und 41. Werner-von-Siemens-Ring verliehen. Zum einen an Prof. Dr. Stefan Hell vom Max-Planck-Institut für Multidisziplinäre Naturwissenschaften für die Entwicklung der Nanomikroskopie, die den Blick auf die molekulare Ebene in lebenden Zellen erlaubt. Zum anderen an das BioNTech-Team bestehend aus Prof. Dr. Christoph Huber, Prof. Katalin Karikó, PhD, Prof. Dr. Uğur Şahin und Prof. Dr. Özlem Türeci für die Erschließung der mRNA-Technologie, die damit ein neues Zeitalter der medizinischen Praxis eröffnet haben.
Stefan Hell erklärt in seiner Rede zur Preisvergabe, wie er eine bisher unüberwindbar geglaubte Grenze umging.
Meine Damen und Herren, wie Sie sicher wissen: Ein Bild sagt mehr als tausend Worte. Das gilt natürlich nicht nur im täglichen Leben, sondern auch in der Wissenschaft. Deswegen ist es nicht verwunderlich, dass die Entwicklung der Lichtmikroskopie im 17. und 18. Jahrhundert dazu geführt hat, dass man die Welt wörtlich, um Herrn Patrick Cramer [Laudator für Stefan Hell; Anmerkung der Redaktion] zu zitieren, mit ganz neuen Augen gesehen hat, Dinge entdeckt hat, die man vorher nie sah.
Man entdeckte, dass jedes Lebewesen aus Zellen besteht als den fundamentalen funktionellen und strukturellen Einheiten. Man entdeckte Organellen innerhalb der Zelle, wie zum Beispiel Mitochondrien und Chloroplasten. Aber irgendwann entdeckte man auch, dass man mit dem Lichtmikroskop nicht mehr weiterkam. Wenn man etwas schärfer auflösen wollte als etwa 200 Nanometer – also ein Fünftel eines tausendstel Millimeters – so ging das nicht mehr.
Aus diesem Grund erfand man hier in Berlin vor etwa 80 Jahren das Elektronenmikroskop, das nicht mehr Licht verwendete, sondern Elektronen. Und in dem Elektronenmikroskop gelang es tatsächlich, bis auf atomare Skalen herunterzukommen. Damit stellte sich die Frage – erst recht für einen Physiker, und Frau Denz [Vorsitzende des Stiftungsrats; Anmerkung der Redaktion] wird mir da zustimmen – warum überhaupt noch Lichtmikroskopie, wenn man doch das Elektronenmikroskop erfunden hat?
Die Antwort ist einfach: Mit einem Elektronenmikroskop kann man kein lebendes Material beobachten. Das geht einfach nicht. Und es gibt noch einen anderen Grund, weshalb die Lichtmikroskopie, außer ihrer Eigenschaft, lebende Zellen zu beobachten, so speziell ist: Man weiß ja mittlerweile, was eine Zelle enthält. Aber was wirklich interessiert, ist ein bestimmtes Protein: was es macht, wo es hingeht, wann es hochreguliert ist, wann es nicht da ist. Das kann ich mit einem Lichtmikroskop sehr, sehr gut machen, indem ich ein Fluoreszenzmolekül an das Protein, das mich interessiert, anhefte und es so hervorhebe.
Indem ich das Fluoreszenzsignal des angehefteten Fluoreszenzmoleküls beobachte, weiß ich letztendlich, wo das Protein ist, das mich interessiert. Diese Eigenschaft macht das Lichtmikroskop einzigartig und deswegen war es interessant, sich zu fragen: Gibt es nicht doch eine Physik, die einem erlauben würde, deutlich schärfere Bilder zu erzielen? Dies war eigentlich das, was mich angetrieben hat. Es war nicht die Anwendung, sondern einfach die Frage: Gibt es nicht doch eine Physik, die einem erlaubt, die in der Physik akzeptierte Grenze zu überlisten?
Ich möchte Ihnen kurz einmal zeigen, was das eigentliche Problem war und wie so oft lässt sich dies ziemlich einfach veranschaulichen. Ein Mikroskop hat als wichtigstes Element das Objektiv. Das ist eine Linse. Die Linse hat die Aufgabe, Licht auf den Punkt zu fokussieren. Aber weil Licht sich als Welle ausbreitet, schafft die Linse es nicht, einen dieser schwarzen Punkte – nehmen wir an, das sei ein Molekül – punktgenau exakt zu treffen. Die Welleneigenschaft des Lichts führt nämlich dazu, dass ich in der Probe immer einen Fleck von Licht bekomme. Und dieser Fleck hat eine Ausdehnung von 200 Nanometern im Durchmesser. Und das bedeutet, ich treffe nicht nur einen Punkt, also ein einziges Molekül, sondern viele gleichzeitig.
Und wenn ich viele Moleküle gleichzeitig treffe, – die in diesem Fall alle fluoreszieren – würden natürlich alle, die ich treffe, auch ein Signal aussenden. Dieses Signal, hier gelbes Fluoreszenzlicht, würde von der gleichen Linse aufgenommen und auf einen Detektor zugeführt werden.
Aber auch dieses Licht ist natürlich eine Welle und macht vor dem Detektor einen Fleck. Und so bekomme ich viele Flecken; von jedem Molekül eins. Und egal, was für einen Detektor ich nehmen würde – das kann das Auge sein; das kann eine ganz teure, tolle Kamera sein – am Ende des Tages würde ich es nicht schaffen, diese Signale auseinanderzuhalten. Deswegen schafft man es nicht, diese Moleküle, die gleichzeitig von dem grünen Licht getroffen werden, zu trennen.
Das dachte man. Der Mann der das herausgefunden hat, war Ernst Abbe. Er lebte zum Ausgang des 19. Jahrhunderts und er formulierte dieses Auflösungsproblem in einer Gleichung, die heute doch seinen Namen trägt. Sie besagt: Wenn ich etwas trennen will, dann muss es mindestens die Wellenlänge Lambda geteilt durch zweimal diesen Zahlenwert im Nenner entfernt sein – das ist sowas wie zwei oder drei – und so kommt man auf diese 200 Nanometer. Das schien die endgültige Grenze zu sein.
Diese Formel findet man nicht nur in jedem Lehrbuch der Physik und auch in Lehrbüchern der Biologie, sondern auch auf einem Denkmal, das zu Ehren von Ernst Abbe in Jena errichtet worden ist. Und dort ist diese Formel in Stein gemeißelt. Und nicht nur, dass sie in Stein gemeißelt ist, es war auch Fakt. Durch das ganze 20. Jahrhundert hinweg war die höchste Auflösung, die man erreichen konnte wirklich das, was Sie hier sehen.
Die Entwicklung der STED-Mikroskopie, wie Patrick Cramer so schön ausgeführt hatte, hat gezeigt, dass das nicht stimmt. Man kann sehr wohl eine Physik finden, die diese Grenze fundamental überwindet. Das ist eine ihrer ersten und wichtigsten Leistungen gewesen. Ich möchte zeigen, was der Trick war. Er war im Nachhinein gesehen wirklich einfach. Im Nachblick ist es immer einfach.
Das Laserlicht wird auf diesen großen, grünen Fleck fokussiert, der eine ähnliche Ausdehnung hat, und der dazu führt, dass alle Moleküle leuchten. Aber was vergessen worden ist, fiel mir tatsächlich an diesem Samstagvormittag 1993 in Finnland ein – ich kann mit Laserlicht nicht nur Moleküle anschalten, sondern ich kann sie auch ausschalten. Ich muss nur die richtige Wellenlänge nehmen.
Genau das war die Idee hinter diesem STED-Verfahren. Ich nehme rotes Licht, das dazu dient, diese Fluoreszenz zu verhindern, sodass sie erst gar nicht entsteht. Wenn ich es dann schaffe, einen Lichtfleck zu erzeugen, der ein Loch in der Mitte hat, schaffe ich es auf diese Weise, alle Moleküle auszuschalten bis auf das eine in der Mitte. Das Ganze verhält sich dann so, als hätte ich wirklich nur dieses eine Molekül adressiert. Dann ist das Kuddelmuddel am Detektor plötzlich weg, denn ich erhalte nur von einem einzigen Molekül ein Signal.
Wenn ich das Ganze dann über die vielen Moleküle hier in einer Probe rastere, habe ich natürlich eine bessere Auflösung, weil ich auf einmal diese Moleküle voneinander trennen kann. Das war die Idee der STED-Mikroskopie, 1994 theoretisch publiziert in Turku in Finnland, wo ich, wie meine Frau sagen würde, damals im Asyl war, weil ich in Deutschland keinen Job gefunden hatte.
Da könnte man meinen: Das ist eine gute Idee, die sollte man jetzt fördern. Ich habe etwa vier, fünf Jahre gebraucht, bis ich das Glück hatte, nach Göttingen an das Max-Planck-Institut für biophysikalische Chemie zu kommen, wo ich eine Nachwuchsgruppe aufbauen konnte, um diese Idee zu testen.
Dort hat man gesagt: Wir haben auch nicht richtig geglaubt, dass es funktioniert, die Beugungsgrenze zu überwinden, aber du warst der Einzige, der daran gearbeitet hat. Und wenn man dich jetzt nicht daran arbeiten lässt, dann wissen wir nicht, ob es geht oder nicht.
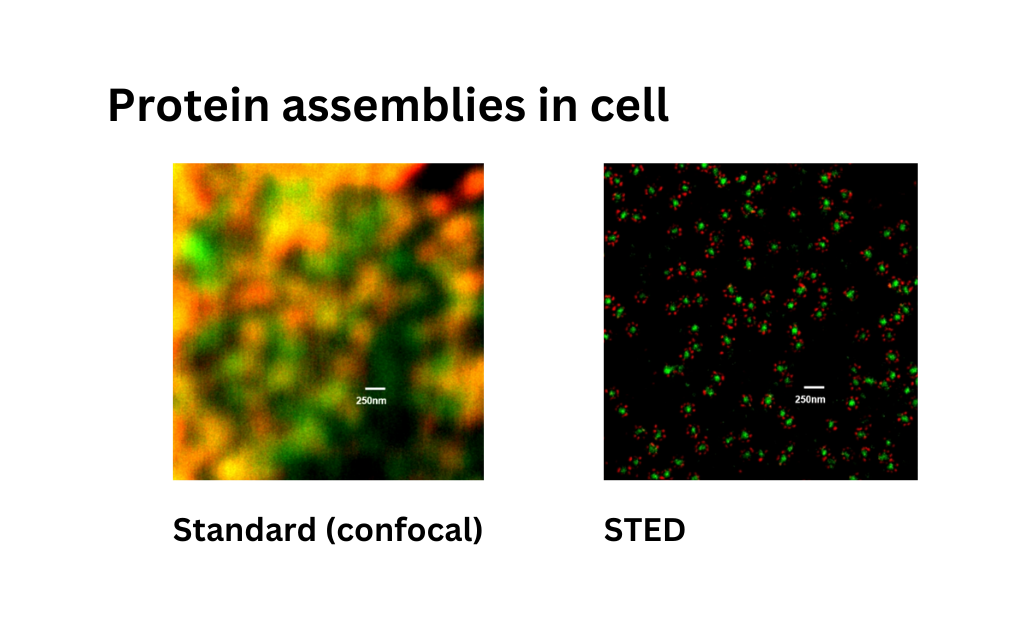
Dass es gegangen ist, wissen Sie – und das zeige ich Ihnen jetzt mal im Vorher-Nachher-Bild.
Dieses Bild war der Standard, konfokal würde man im Fachjargon sagen. Und dieses Bild war nachher. Man sieht, wenn man in die Details hineinzoomt, dass man eine deutlich höhere Auflösung erhält. Zum Beispiel sieht man die achtfache Symmetrie dieses Kernporenkomplexes. Dieser Vorher-Nachher-Vergleich macht mir heute noch Spaß. Genau dieses Bild finden Sie jetzt in Lehrbüchern für die zwölfte Klasse Biologie im deutschsprachigen Raum, also in Deutschland, in Österreich und in der Schweiz, weil es sehr schön den Auflösungsgewinn symbolisiert.
Wir wussten natürlich, dass das Ganze nur dann Sinn macht und wirklich „useful“ ist, wie man heute sagen würde, wenn man es in die Breite bringt, also in viele Labors der Welt. Deshalb haben 2011/2012 Studenten, ehemalige Studenten, Post-Doktoranden und ich mit den Patenten der Max-Planck-Gesellschaft eine Firma ausgegründet, die mittlerweile dieses STED-Verfahren in verschiedensten Variationen anbietet, von klein, kompakt zu sehr „sophisticated“ und elaboriert.
Das Spezielle an diesen Ausgründungen war, dass wir uns entschieden haben, kein Venture Capital zu nehmen, keine Kredite, keine Schulden zu machen und Wachstum nur über die Einnahmen zu finanzieren. Das hat tatsächlich funktioniert und daran hat sich bis heute nichts geändert. Aber dann kam tatsächlich eine Überraschung – Patrick Cramer hat das erwähnt: der große Preis aus Stockholm.
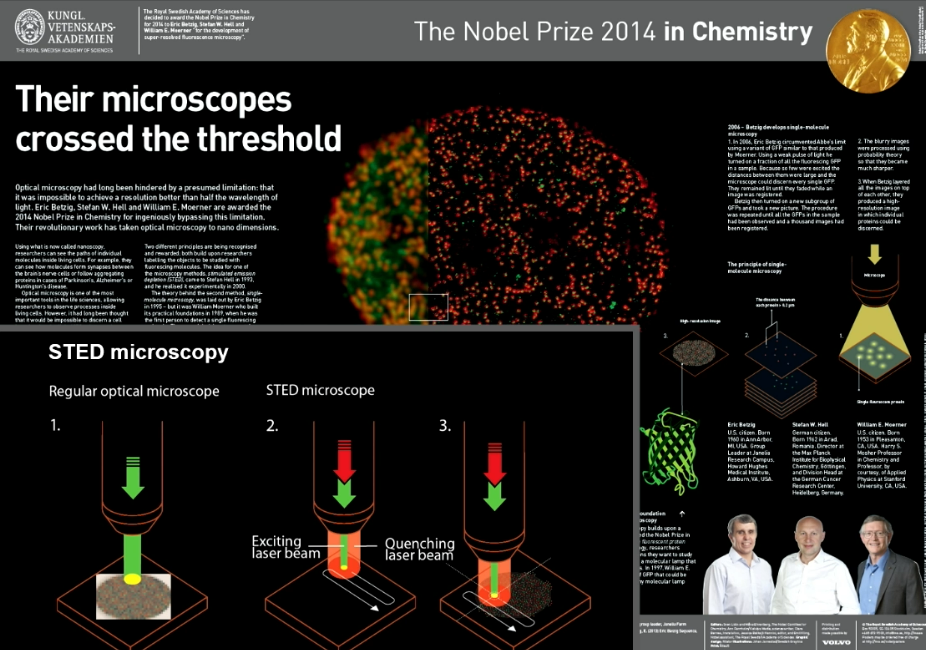
Das ist das Poster der Nobel-Stiftung , das diese Verfahren, die den Preis bekommen haben, nochmals skizziert; links das STED. Ich hatte die Ehre, den Preis mit zwei amerikanischen Wissenschaftlern zu teilen, die im Grunde genommen das gleiche An/Aus-Prinzip zur Trennung verwendet haben. Der Trennmechanismus war nicht neu. Neu war aber, dass sie nicht einen Lichtstrahl mit einem Lochmuster – einen Donut – verwendet haben, um Moleküle an- und auszuschalten, sondern die Moleküle stochastisch einzeln an- und ausgeschaltet haben. Stochastisch heißt zufällige Moleküle an einem unbekannten, zufälligen Ort. Das hat Vor- und Nachteile. Auf jeden Fall ist es auch ein Verfahren, das sehr valide ist und deswegen sind wir alle ausgezeichnet worden.
Ebenfalls interessant in diesem Zusammenhang ist, dass im Prinzip beide Verfahren – schließlich beruhen sie auf dem gleichen An/Aus-Prinzip zum Trennen von Molekülen – eine maximale Auflösung von der Größe eines Fluoreszenzmoleküls haben können. Die ist etwa ein Nanometer. In der Praxis ging es zum Zeitpunkt, als der Preis vergeben worden ist, aber noch nicht. Es waren nur 20 Nanometer möglich. Das war zwar ein Faktor zehn über der alten Auflösungsgrenze. Also schon ordentlich. Aber die absolute Grenze, nämlich ein Nanometer, war nicht erreicht.
Weil wir fasziniert waren von dieser Idee, das Maximum herauszuholen und nicht dachten „That’s it“, sondern „Jetzt erst recht. Wir gucken mal, was wir da rauskriegen“, war das Ziel in unserem Labor in den letzten Jahren, wirklich die maximale Auflösung zu erreichen, nämlich runter bis zur Größe des Moleküls.
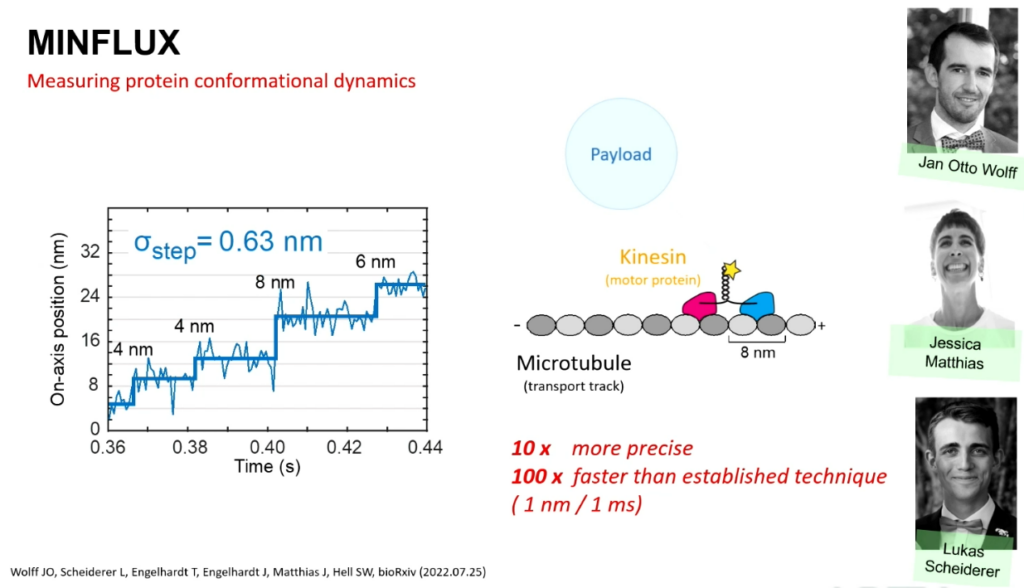
Und das geht in der Tat. Wenn man die Stärken diese beiden Verfahren kombiniert. Das Verfahren, das die Amerikaner zuerst umgesetzt haben, hat den Vorteil, dass man mit einzelnen Molekülen arbeitet. Das ist wirklich ein starker Vorteil. Es hat aber auch Nachteile: Weil ich räumlich stochastisch an und ausschalte, muss ich herauskriegen, wo das Molekül ist. Das kann ich aber sehr gut machen, wenn ich einen Strahl mit einem Loch verwende, also einen Donut. Gesagt, getan. Diese beiden Verfahren haben wir kombiniert zu einem neuen Verfahren, bei dem man die Moleküle einzeln schaltet und diese mit dem Strahl mit einem Loch sucht und findet. Und dieses Verfahren, MINFLUX genannt, hat tatsächlich noch einmal diesen Faktor zehn gebracht.
Sie sehen jetzt wieder Kernporenkomplexe . Ich zoome jetzt hinein. Diese einzelnen orangenen Flecke, die Sie jetzt sehen, kann man einzelnen Molekülen zuordnen. Ich vergleiche das mal mit dem STED-Verfahren, das ja den Preis bekommen hat, und mit dem, was man vor 20 Jahren als die absolute Grenze betrachtet hat. Dazwischen ist jeweils ein Faktor zehn. Das heißt, von ganz rechts bis links ist es insgesamt ein Faktor 100.
Dieses Verfahren MINFLUX ist hochinteressant. Nicht nur, weil es zum ersten Mal bis auf die Molekülgröße hinuntergeht, sondern auch, weil es einem erlaubt, räumliche Strukturänderungen von Proteinen zu sehen, sogenannte konformationelle Änderungen. Wir sehen zum Beispiel die Bewegungen des Proteins Kinesin. Das ist ein Motorprotein, das unter anderem Neurotransmitter in der Zelle transportiert. Dies kann man jetzt deutlich genauer und schneller betrachten; zehnmal präziser oder 100 Mal schneller als bisher.
Diese Schritte kann man jetzt sehr genau vermessen. Und ist auch sehr schnell, zum Beispiel bei physiologischen Konzentrationen von ATP. Das ist sehr wichtig.
Ich weiß, diese Folie sieht jetzt sehr nerdig aus. Aber Paradigmenwechsel in der Wissenschaft kommen oft als kleine und unscheinbare Ergebnisse daher, die auf den ersten Blick nerdig aussehen. Aber dieser hundertfache Gewinn an Geschwindigkeit bei der Vermessung von Proteinstrukturveränderungen im Raum kann ein Game Changer für die Beobachtung von Proteinen werden.
Das war einer der Gründe, weshalb die Ausgründung Abberior Instruments tatsächlich die Lizenzen von der Max-Planck-Gesellschaft nahm, die die Patentrechte innerhält. 2020, also während der Pandemie, ist das MINFLUX-System auf den Markt gebracht worden. Mittlerweile gibt es mehr als zwei Dutzend Bestellungen; Systeme von San Diego bis Shanghai, zwei am National Institute of Health in Bethesda [USA; Anmerkung der Redaktion]. Sie liefern die Auflösung ab, die ich Ihnen vorher gezeigt habe.
Das ist der Stadt Göttingen nicht verborgen geblieben. Die Stadt kam auf uns zu und sagte: Wenn Ihr Platz braucht, bauen wir gerne ein Haus für euch. Da könnt ihr euch einmieten. Das ist in der Tat passiert.
Die Firma wird es in einem halben Jahr beziehen können. Mittlerweile haben wir mehr als 100 Mitarbeiter und wachsen immer noch schnell an mehreren Standorten, auch im Ausland. Was mich auch freut: Die meisten Mitarbeiter haben einen akademischen Abschluss. Mehr als ein Drittel haben sogar einen Doktortitel.
Diese Geschichte könnte ich Ihnen nicht erzählen, wenn nicht viele Leute mit Spaß an der Sache und kreativ an der Lösung vieler Detailprobleme gearbeitet hätten. Der eine oder andere ist hier. Ich bin auch ihnen zu großem, großem Dank verpflichtet.
Zusammenfassend: Hundertfache Auflösung, das ist heute möglich. Wer weiß, vor 20 Jahren hätte man sich das nicht vorstellen können. Aber der Schatz, der sich damit auftut, der ist noch nicht gehoben. Davon bin ich überzeugt. Es gibt sicher ein bisher nicht erkanntes Potenzial in vielen Bereichen der Biochemie, natürlich auch der Medizin. Ich denke da an die personalisierte Medizin, Pharmaentwicklung. Gerade, weil man jetzt konformationelle Änderungen sehen kann, an die man noch vor drei Jahren eigentlich nicht gedacht hat. Heute werden sie direkt messbar. Und ich finde, das macht die Sache so spannend. Und, da stimme ich Herrn Cramer zu, das ist nicht „That’s it“, sondern „That’s the beginning“.
Zum Schluss noch eine Lehre, die ich auf diesem Weg mitgenommen habe. Es ist meistens die Neugier, die letztendlich zu echten Durchbrüchen führt. Ich wollte nur wissen, ob es eine Physik gibt, die es erlaubt, die Grenze zu durchbrechen. Auch gilt: echte Durchbrüche haben immer ein ökonomischen Wert. Immer, immer, immer. Davon bin ich überzeugt. Ausnahmslos. Vielleicht nicht immer im nächsten Jahr, aber sie haben immer einen ökonomischen Wert. Und wenn sie einen ökonomischen Wert haben, dann führen sie natürlich auch zu Jobs und kommen, und das ist ganz im Sinne des Werner-von-Siemens-Rings, uns allen zugute.
Herzlichen Dank!
Aufzeichnung der Festveranstaltung
Rede des Preisträgers Stefan Hell ab 01:29:56